ORIGINAL URL: https://www2.tulane.edu/~wiser/protozoology/notes/api.html
Apikompleksat janë një grup monofiletik i përbërë pothuajse tërësisht nga specie parazitare (d.m.th., pa jetë të lirë). Apikompleksa, së bashku me ciliatet dhe dinoflagelatet, formojnë një grup të rendit më të lartë të njohur si Alveolata. Një karakteristikë kryesore përcaktuese e këtij grupi janë strukturat e rrafshuara të ngjashme me vezikulat - të quajtura alveola kortikale - të cilat gjenden vetëm nën membranën plazmatike. Më parë apikompleksat ishin pjesë e një grupi të quajtur sporozoa dhe ky emër përdoret ende ndonjëherë. Ka pasur disa sugjerime për t'u kthyer përsëri te emri sporozoa (Cox, Tr. Parasitol. 18:108 ).
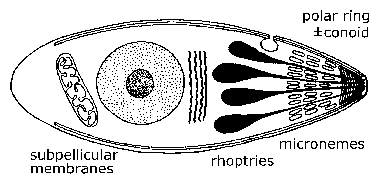
Mikroskopi elektronik zbuloi veçori unike ultrastrukturore midis sporozoarëve të ndryshëm, të cilat u përdorën më pas për të ripërcaktuar grupet. Një karakteristikë përcaktuese e apikompleksit është një grup organelesh që gjenden në një skaj - i quajtur fundi apikal - i organizmit. Ky 'kompleks apikal' përfshin organele sekretuese të njohura si mikroneme dhe rhoptries , unaza polare të përbëra nga mikrotubula dhe në disa specie një konoid që shtrihet brenda unazave polare. Në një moment gjatë ciklit të tyre jetësor, anëtarët e apikompleksit ose pushtojnë ose bashkohen me qelizat pritëse. Pikërisht gjatë kësaj faze invazive (dhe/ose lëvizëse) shprehen këto organele apikale si dhe membranat nënpelikulare, të cilat në fakt janë alveola kortikale. Organelet apikale luajnë një rol në ndërveprimin e parazitit me qelizën pritëse dhe në pushtimin e mëvonshëm të qelizës pritëse. (Shih diskutimin e detajuar mbi pushtimin e qelizave bujtëse nga paraziti i malaries.) Format lëvizëse të apikompleksës zvarriten përgjatë nënshtresës në një mënyrë jo-ameboide të njohur si lëvizshmëri rrëshqitëse. Shumë specie apikompleksane kanë gamete me flagjele .
 |
 |
| Struktura e përgjithshme e Apikompleksit dhe Cikli i Jetës . Format invazive dhe/ose lëvizëse të apikompleksit shfaqin veçori dalluese ultrastrukturore të cilat mund të shihen me mikroskop elektronik. Në fundin apikal është një unazë mikrotubulash e njohur si unaza polare. Ndonjëherë shihet edhe një strukturë e përpunuar citoskeletore e njohur si konoid. Vezikula të vogla eliptike të njohura si mikroneme shihen gjithashtu në këtë fund, si dhe organele në formë pika loti të quajtura rhoptries. | |
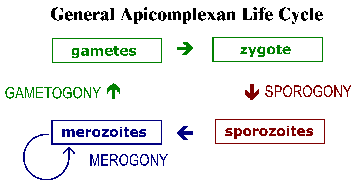
Apikomplekset kanë cikle jetësore komplekse që karakterizohen nga tre procese të dallueshme: sporogonia, merogonia dhe gametogonia (Figura). Megjithëse shumica e apikomplekseve shfaqin këtë cikël të përgjithshëm të jetës, detajet mund të ndryshojnë midis specieve. Për më tepër, terminologjia e përdorur për të përshkruar këto faza të ndryshme të ciklit jetësor ndryshon midis specieve. Cikli jetësor përbëhet nga format e riprodhimit aseksual dhe fazat seksuale. Në speciet monokse, të tre këto procese do të kryhen në një bujtës të vetëm dhe shpesh në një lloj ose ind qelize të vetme. Ndërsa, te speciet heteroksene proceset e ndryshme do të kryhen në bujtës të ndryshëm dhe në përgjithësi përfshijnë inde të ndryshme.
Sporogonia ndodh menjëherë pas një faze seksuale dhe konsiston në një riprodhim aseksual që arrin kulmin me prodhimin e sporozoideve. Sporozoitët janë një formë invazive që do të pushtojë qelizat dhe do të zhvillohet në forma që i nënshtrohen një riprodhimi tjetër aseksual të njohur si merogonia. Merogony dhe merozoitët që rezultojnë njihen me emra të ndryshëm në varësi të specieve. Ndryshe nga sporogonia, në të cilën përgjithësisht ka vetëm një raund replikimi, mjaft shpesh ka raunde të shumta merogonie. Me fjalë të tjera, merozoitët, të cilët janë gjithashtu forma invazive, mund të ripushtojnë qelizat dhe të fillojnë një raund tjetër merogonie. Ndonjëherë këto raunde të shumta të merogonisë do të përfshijnë një ndërrim në organizmin pritës ose një ndryshim në llojin e qelizës së pushtuar nga paraziti që rezulton në faza të dallueshme të merogonisë. Si një alternativë ndaj replikimit aseksual, merozoitët mund të zhvillohen në gametë përmes një procesi të quajtur ndryshe gametogoni, gamogoni ose gametogjenezë. Ashtu si në llojet e tjera të riprodhimit seksual, gametet bashkohen për të formuar një zigotë e cila do t'i nënshtrohet sporogonisë.
Apikomplekset janë një grup jashtëzakonisht i madh dhe i larmishëm (> 5000 lloje të emërtuara). Shtatë specie infektojnë njerëzit (Kutia). Plazmodiumi , si agjenti shkaktar i malaries, ka ndikimin më të madh në shëndetin e njeriut. Babesia është një infeksion zoonotik relativisht i rrallë. Pesë speciet e tjera klasifikohen të gjitha si kokcidia. Sidoqoftë, të dhënat e fundit molekulare tregojnë se Cryptosporidium është më i lidhur me gregarinat sesa me kokcidiet. Kokcidiet përgjithësisht konsiderohen patogjenë oportunistë dhe shpesh shoqërohen me SIDA. Disa parazitë apikompleks janë gjithashtu të rëndësishëm për sa i përket mjekësisë veterinare dhe bujqësisë. Më të dukshmet janë Babesia dhe Theileria në gjedhë dhe Eimeria në shpendë.
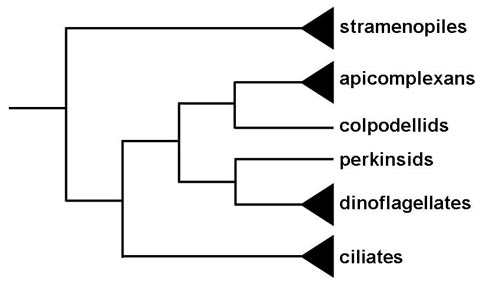
Historikisht apikomplekset janë përshkruar si një grup me vetëm forma parazitare. Kjo dhe organelet e tyre unike apikale ngrenë pyetje në lidhje me origjinën e grupit. Analiza filogjenetike tregon se anëtarët ose gjinia Copodella formojnë një grup simotër me apikompleksin (1). Kolpodelidët janë flagjelate grabitqare që ushqehen me alga njëqelizore me një proces të quajtur mizocitozë. Mizocitoza përfshin grabitqarin (ose parazitin) që ngjitet me gjahun (ose bujtësin) dhe fjalë për fjalë thith citoplazmën e qelizës së gjahut nëpërmjet strukturave të specializuara. Kjo lidhje dhe ndërveprim me qelizën e gjahut ndërmjetësohet nga organele të ngjashme me ato që apikompleksat përdorin për ngjitjen ose pushtimin e qelizave pritëse. Kështu, evolucioni i apikompleksit ka të ngjarë të evoluojë nga ky grabitje mizocitoike në parazitizëm mizocitoik, siç u shfaq nga gregarina dhe Cryptosporidium , në parazitizëm ndërqelizor.
Organizma të tjerë mizocitoikë me apikompleks si organele apikale përfshijnë Perkinsus , parazitët e gocave të detit dhe molusqeve, dhe Parvilucifera , një grabitqar i dinoflagelateve. Megjithatë, këto perkinside formojnë një grup simotër me dinoflagelatet dhe jo me apikompleksat (Figura). Kjo sugjeron se paraardhësi i klades dinoflagelat dhe apikompleks mund të ketë qenë një flagjelate grabitqare dhe se organelet apikale janë mbajtur në kladin apikompleks, por kanë humbur në pjesën më të madhe të kladit dinoflagelat.
|
 |
 |
 |
 |
KOKSIDI
Kokcidi karakterizohet nga një stad oocisti me mure të trasha që zakonisht ekskretohet me feces. Disa kokcidia ( Cryptosporidium, Cyclospora, Isospora ) kryejnë të gjithë ciklin e tyre jetësor brenda qelizave epiteliale të zorrëve të bujtësit dhe transmetohen përmes rrugës fekalo-orale. Kokcidia të tjera ( Sarcocystis, Toxoplasma ) kanë një cikël jetësor më të ndërlikuar që përfshin kiste të indeve dhe bujtës të shumtë (dmth., heteroksenë).
Kriptosporidiumi
Që nga identifikimi i tij fillestar në 1907, disa lloje Cryptosporidium janë identifikuar në një shumëllojshmëri të gjerë kafshësh duke filluar nga peshqit te njerëzit. Rastet e para tek njerëzit e kriptosporidiozës u raportuan në vitin 1976 dhe u karakterizuan si një sëmundje diarreike e shoqëruar me shtypjen e imunitetit. Fillimisht besohej se ishte një sëmundje e rrallë dhe ekzotike. Gjatë viteve 1980, Cryptosporidium u njoh si shkaku kryesor i diarresë në pacientët me AIDS dhe shpesh rezulton me vdekje. Megjithatë, tani është e njohur se Cryptosporidium është një shkak i zakonshëm i diarresë në personat imunokompetent dhe ndoshta ka qenë një patogjen njerëzor që nga fillimi i njerëzimit. Janë identifikuar dy lloje që infektojnë njerëzit: C. parvum dhe C. hominis .
CIKLI I JETES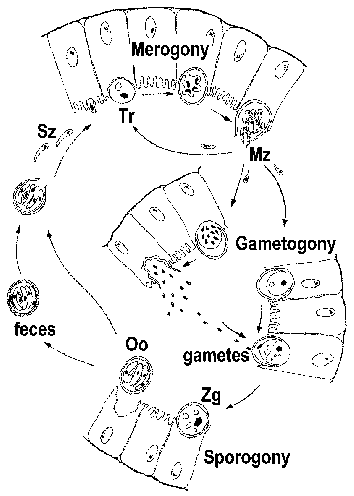
Cryptosporidium shpesh klasifikohet si një kokcidian dhe shfaq një cikël jetësor të ngjashëm me kokcidiet e tjera të zorrëve. Megjithatë, Cryptosporidium është më i lidhur me gregarinat dhe kjo reflektohet në disa aspekte të ciklit të tij jetësor. Infeksioni fitohet nëpërmjet gëlltitjes së oocisteve të sporuluara (Figura). [ Shih figurën më të madhe të ciklit jetësor me legjendë të detajuar .] Ndryshimet e pH-së që lidhen me kalimin nëpër zorrë dhe lëngjet biliare dhe pankreatike në zorrën e hollë shkaktojnë ekzistimin. Sporozoitët (Sz) dalin nga oocisti dhe ngjiten në qelizat epiteliale të zorrëve. Ndryshe nga kokcidiet e tjera, sporozoitet Cryptosporidium nuk pushtojnë enterocitet. Në vend të kësaj, ato nxisin shkrirjen dhe zgjerimin e mikrovileve duke rezultuar që paraziti të rrethohet nga një membranë e dyfishtë me origjinë bujtëse. Një bashkim, i quajtur 'organela ushqyese' ose 'zona e ngjitjes', formohet midis parazitit dhe enterocitit pritës. Paraziti, i quajtur tani një trofozoit (Tr), ka të ngjarë të marrë lëndë ushqyese nga qeliza pritëse nëpërmjet këtij kryqëzimi. (Për një rishikim mbi procesin e 'pushtimit' shih Borowski et al, 2008. )
Trofozoitët i nënshtrohen një replikimi aseksual (dmth., merogonia) dhe prodhojnë 4-8 merozoitë (Mz) të cilat lëshohen në lumenin e zorrëve. Merozoitët infektojnë qelizat e reja të epitelit të zorrëve dhe i nënshtrohen raundeve shtesë të merogonisë. Rritja e ashpërsisë së sëmundjes në pacientët me imunitet të kompromentuar është pjesërisht për shkak të paaftësisë së tyre për të kufizuar këto raunde shtesë të merogonisë.
Si një alternativë ndaj merogonisë, merozoitët mund të zhvillohen në makro- ose mikrogametocite pas infeksionit të një enterociti. Mikrogametogjeneza përfshin disa raunde replikimi të ndjekura nga lëshimi i mikrogameteve të shumta në lumenin e zorrëve. Mikrogametet fekondojnë makrogametet ende të lidhura me qelizat epiteliale të zorrëve. Zigota që rezulton (Zg) i nënshtrohet sporogonisë dhe oocistet e sporuluara (Oo) ekskretohen me feces. Një autoinfeksion është gjithashtu i mundur dhe kjo gjithashtu mund të kontribuojë në rritjen e ashpërsisë së sëmundjes në pacientët me imunitet të kompromentuar.
TRANSMISIONI DHE EPIDEMIOLOGJIA MOLEKULARE
Faktorët e rrezikut të transmetimit të Cryptosporidium janë të ngjashëm me sëmundjet e tjera fekalo-orale. Megjithatë, shpërthimet e kriptosporidiozës me origjinë uji kanë qenë veçanërisht të dukshme. Më e famshmja është një shpërthim në Milwaukee gjatë pranverës së vitit 1993, në të cilën rreth 400,000 njerëz zhvilluan kriptosporidiozë simptomatike (MacKenzie et al, New Eng. J. Med. 331:161, 1994 ). Faktorët që kontribuojnë në rritjen e rreziqeve të shpërthimeve të ujit të Cryptosporidium janë:
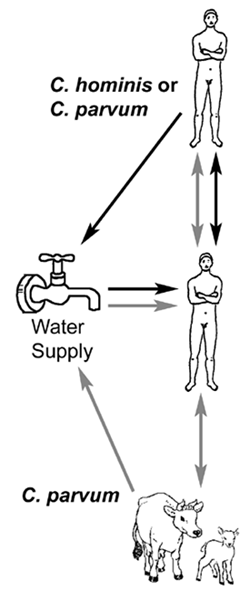
- madhësia e vogël e oocisteve
- gamë të gjerë të specifikës së bujtësit dhe zhvillimit monoksen
- lidhjet e ngushta ndërmjet nikoqirëve të njerëzve dhe kafshëve
- numër i madh i oocisteve të ekskretuara (deri në 100 miliardë për viç)
- dozë të ulët infektive
- oociste të fuqishme të cilat janë rezistente ndaj klorit
- okistet infektive të sporuluara të ekskretuara
PATOGJENEZA
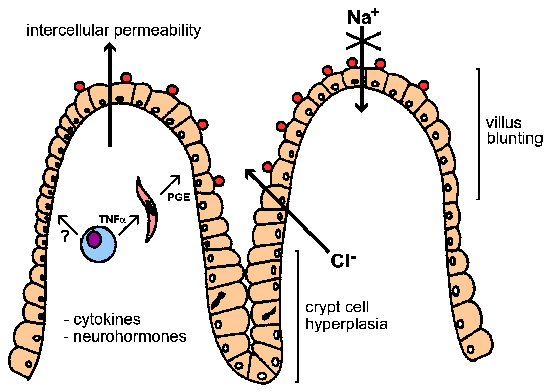
Manifestimi klinik më i zakonshëm i kriptosporidiozës është një diarre ujore e lehtë deri në bollëk. Kjo diarre në përgjithësi është vetëkufizuese dhe vazhdon nga disa ditë deri në një muaj. Rekrutimet janë të zakonshme. Ngërçet e barkut, anoreksia, të përzierat, humbja e peshës dhe të vjellat janë manifestime shtesë që mund të ndodhin gjatë fazës akute. Sëmundja mund të jetë shumë më e rëndë për personat me SIDA e cila manifestohet si një diarre kronike që zgjat me muaj apo edhe vite. Disa pacientë me AIDS shfaqin një sëmundje të ndezur të ngjashme me kolerën, e cila kërkon terapi intravenoze të rihidrimit. Shkalla e vdekshmërisë mund të jetë mjaft e lartë në këto raste të ndezura. Diarreja mund të ketë përbërës osmotikë, inflamatorë ose sekretues (shih Kutinë). Natyra ujore e diarresë e lidhur me infeksionet Cryptosporidium ka sugjeruar praninë e një enterotoksine. Megjithatë, nuk ka asnjë provë për një diarre sekretore të ndërmjetësuar nga toksina, pavarësisht përpjekjeve për të identifikuar një toksinë të tillë. Provat eksperimentale sugjerojnë që përthithja e Na + e shoqëruar me glukozë është zvogëluar dhe sekretimi i Cl- është rritur. Prandaj, diarreja e lidhur me Cryptosporidium duket të jetë kryesisht osmotike në natyrë (shih Figurën). E lidhur me këtë ndërprerje të funksionit të enterociteve (dmth, qelizave epiteliale të zorrëve) është një zbehje e vileve dhe hiperplazia e qelizave të kriptit. Një mekanizëm i mundshëm i patogjenezës është se infeksioni i qelizave epiteliale të zorrëve me Cryptosporidium dëmton enterocitet dhe përfundimisht çon në vdekjen e tyre. Kjo shkakton ndarjen e qelizave në rajonin e kriptës (dmth. hiperplazinë) për të zëvendësuar qelizat e dëmtuara. Kombinimi i shkatërrimit të qelizave absorbuese në majat e vileve dhe rritja e kriptës sekretuese të Cl - së çon në një sekretim të përgjithshëm të zgjeruar.
|
|
REFERENCAT SHTESË
- Clark DP, Sears CL (1996) Patogjeneza e kriptosporidiozës. Parazitologjia Sot 12:221
- Guerrant RL (1997) Kriptosporidioza: një kërcënim në zhvillim, shumë infektiv. Shfaqen. Inf. Dis. 3:51
- Greg Hannahs, Cryptosporidium parvum : një patogjen në zhvillim. http://biology.kenyon.edu/slonc/bio38/hannahs/crypto.htm
- NE Ramirez, LA Ward dhe S Sreevatsan (2004) Një përmbledhje e biologjisë dhe epidemiologjisë së kriptosporidiozës tek njerëzit dhe kafshët. Microbes and Infection 6, 773-785 .
- Rose JB, Huffman DE, Gennaccaro A (2002) Rreziku dhe kontrolli i kriptosporidiozës së shkaktuar nga uji. FEMS Microbiol. Zbul. 26:113 .
- Sunnotel, O et al (2006) Cryptosporidium . Letrat në Mikrobiologjinë e Aplikuar 43, 7-16 .
- Xiao L dhe Ryan UM (2004) Kriptosporidioza: një përditësim në epidemiologjinë molekulare. Opinionet aktuale në sëmundjet infektive 17, 483-490 .
- Xiao, L. dhe Feng, Y. (2008) Kriptosporidioza zoonotike. FEMS Immunology & Medical Microbiology 52: 309-323 .
 |
 |
 |
 |
Isospora
Isospora belli besohet të jetë një specie e vlefshme që infekton vetëm njerëzit. Ka një shpërndarje në mbarë botën, por është më e zakonshme në rajonet tropikale dhe zonat me kanalizime të dobëta. Infeksionet janë shpesh asimptomatike dhe ato me simptoma priren të jenë vetëkufizuese me një kohëzgjatje prej disa javësh. Infeksionet janë më të shpeshta dhe simptomat më të rënda te të sëmurët me SIDA sesa te personat imunokompetent. Cikli i jetes . Infeksioni fitohet nëpërmjet gëlltitjes së oocisteve të sporuluara (sOo). Sporozoitët (Sz) lëshohen në lumenin e zorrëve dhe pushtojnë qelizat epiteliale të zorrëve. Brenda qelizave epiteliale paraziti i nënshtrohet një raundi merogonie që çon në prodhimin e merozoiteve (Mz). Merozoitët e çliruar riinvadojnë qelizat epiteliale të zorrëve dhe mund t'i nënshtrohen raundeve shtesë të merogonisë ose të zhvillohen në mikro- ose makrogamontë. Mikrogametet (ga) do të fekondojnë makrogametet (ga) për të formuar një zigotë (Zy) e cila zhvillohet në oocist (Oo). Oocistet e papjekura kalojnë në feces dhe maturimi në oocista të sporuluara infektive ndodh në mjedis. Fazat e njohura gjatë këtij maturimi (d.m.th., sporogonia) përfshijnë oocistet me një sporoblast të vetëm, oocistet me dy sporoblaste dhe oocitin e pjekur me dy sporociste, secila prej të cilave përmban katër sporozoite. [Shih gjithashtu diskutimin e detajuar të ciklit jetësor të Cryptosporidium .]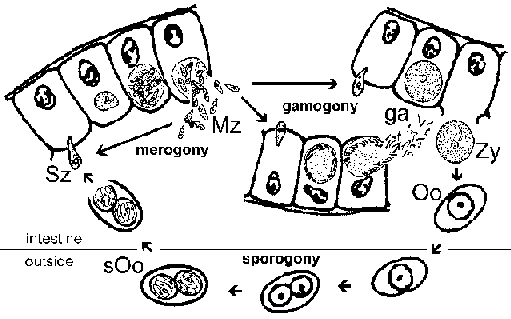
Ciklospora
Rastet e para njerëzore të Cyclospora cayetanensis u raportuan në vitin 1979. Fillimisht u referua si trupa të ngjashëm me cianobakteret ose trupa të ngjashëm me kokcidianin (CLB). Organizmi u konfirmua të ishte një parazit koksidian me një strukturë oociste të ngjashme me gjininë Cyclospora dhe më pas u emërua në 1994 sipas Universidad Peruana Cayetano Heredia në Peru, ku ishin kryer shumica e studimeve të hershme. Studimet molekulare tregojnë një lidhje të ngushtë me Eimeria, një parazit i rëndësishëm veterinar i shpendëve dhe bagëtive të tjera. C. cayetanenis ka një shpërndarje në mbarë botën, por duket se është veçanërisht e përhapur në Amerikën Latine, nënkontinentin Indian dhe Azinë Juglindore. Në vendet e zhvilluara, infeksionet zakonisht shoqërohen ose me shpërthime ushqimore ose me diarre të udhëtarëve.
Cikli jetësor dhe transmetimi . Cikli jetësor i Cylcospora është i ngjashëm me Isospora ( shih më lart ). Infeksioni fitohet nëpërmjet gëlltitjes së oocisteve. Sprorozoitët çlirohen dhe infektojnë qelizat epiteliale të pjesës së sipërme të zorrës së hollë. Paraziti i nënshtrohet merogonisë dhe merozoitët riinfektojnë enterocitet dhe mund të ndodhin disa raunde të tjera merogonie. Disa nga merozoitët i nënshtrohen një zhvillimi seksual që rezulton në prodhimin e mikro- dhe makrogameteve. Fekondimi i makrogametit nga mikrogameti fillon sporogoninë dhe formimin e oocistit. Ashtu si Isospora , sporulimi përfundon në mjedis dhe oocistet e papjekura jo infektive ekskretohen në feces. Maturimi i oocisteve në oociste infektive të sporuluara ndoshta zgjat nga ditë deri në javë. Përveç kësaj, struktura e oocistit Cyclospora është e ndryshme nga ajo e Isospora . Oocisti përmban dy sporociste të cilat secili përmban dy sporozoite.
Disa shpërthime në Shtetet e Bashkuara dhe Kanada janë shoqëruar me produkte të freskëta të importuara nga Amerika e Jugut dhe Qendrore (Tabela). Në veçanti, manaferrat dhe perimet me gjethe janë identifikuar si artikulli i mundshëm i kontaminuar. Këto janë artikuj ushqimorë që zakonisht hahen të papërpunuara dhe vetëm shpëlahen. Asnjë shpërthim nuk është shoqëruar me fruta ose perime të ngrira, të përpunuara ose të qëruara. Një sezonalitet në shpërthime është vërejtur gjithashtu me shumicën e rasteve të ndodhura në pranverë dhe fillim të verës. Një sezonalitet i ngjashëm është vërejtur edhe në vendet endemike. Ndryshe nga Shtetet e Bashkuara dhe Kanadaja, ku dominon transmetimi me anë të ushqimit, shumica e rasteve në Evropë dhe Australi janë shoqëruar me udhëtime në vendet endemike.
Shpërthimet e zgjedhura të ciklosporiazës në Shtetet e Bashkuara dhe Kanada |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Si rezultat i numrit të lartë të shpërthimeve të lidhura me mjedrat nga Guatemala, Shtetet e Bashkuara kufizuan importin e mjedrave dhe kërkonin inspektimin e fermave. Kjo rezultoi në një rënie të mëvonshme të numrit të shpërthimeve në Shtetet e Bashkuara. Kanadaja, e cila nuk kufizoi importet, nuk pësoi një rënie të numrit të shpërthimeve gjatë kësaj periudhe. Studimet e mëvonshme të kontrolluara nga rastet e kryera në Guatemalë zbuluan se infeksionet ishin më të zakonshme tek fëmijët me prevalencën kulmore në qershor. Faktori kryesor i rrezikut i lidhur me infeksionin ishte pirja e ujit të patrajtuar. Në Peru, kontakti me tokën u identifikua si një tjetër faktor rreziku, veçanërisht tek fëmijët nën dy vjeç. Trajtimi joadekuat i ujit në këto vende endemike mund të çojë në ndotjen e ujërave nëntokësore dhe kështu të ruajë ciklin e transmetimit. Me sa duket, transmetimi nga ushqimi është për shkak të ujitjes ose aplikimit të plehrave me ujë të kontaminuar ose larjes dhe përpunimit të ushqimeve me ujë të trajtuar keq.
Simptomat . Cyclospora kryesisht infekton qelizat epiteliale në pjesën e sipërme të zorrëve të vogla. Periudha e inkubacionit është përgjithësisht një deri në dy javë. Simptomat janë të ngjashme me gastroenteritin e shkaktuar nga Isospora dhe Cryptosporidium i cili zakonisht përfshin cikle të diarresë ujore dhe periudha të faljes së dukshme. Diarreja karakterizohet nga jashtëqitje të shpeshta dhe mund të zgjasë deri në gjashtë javë, por në përgjithësi është vetëkufizuese në personat me imunokompetencë. Anoreksia, keqtrajtimi, vjellja dhe ngërçet janë simptoma të tjera të shpeshta që lidhen me ciklosporiazën. Në disa raste pacientët mund të përjetojnë të vjella, dhimbje muskujsh, humbje të konsiderueshme në peshë dhe diarre shpërthyese. Ekspozimi i mëparshëm ndaj Cyclospora duket se jep njëfarë rezistence ndaj infeksionit me një pakësim të simptomave. Me kalimin e kohës të rriturit duket se zhvillojnë imunitet dhe transportuesit asimptomatikë mund të gjenden në zonat endemike.
Siç është edhe rasti për Cryptosporidium dhe Isospora , diarreja e shkaktuar nga Cyclospora në pacientët me AIDS është shumë më e rëndë sesa te personat imunokompetent. Diarreja mund të zgjasë me muaj dhe të prodhojë një sindromë që është dobësuese dhe kërcënuese për jetën.
Vlerësime të Cyclospora:
Sterling dhe Ortega (1999) Clycospora : një enigmë që ia vlen të zbulohet. Shfaqen. Inf. Dis. 5:48 .
BL Herwaldt (2000) Cyclospora cayetanensis : Një përmbledhje që fokusohet në shpërthimet e kliklosporiazës në vitet 1990. Klin. Inf. Dis. 31:1040 .
JM Shields dhe BH Olson (2003) Cyclospora cayetanensis: një përmbledhje e një koksidiani parazitar në zhvillim. International Journal for Parasitology 33, 371-391 .
LS Mansfield dhe AA Gajadhar (2004) Cyclospora cayetanensis , një parazit kokcidian i transmetuar nga ushqimi dhe uji. Parazitologjia Veterinare 126: 73-90 .
YR Ortega dhe R Sanchez (2010) Cyclospora cayetanensis , një parazit i lindur nga ushqimi dhe uji. Klin. Mikrobiol. Zbul. 23:218-234 .
 |
 |
 |
 |
Diagnoza dhe trajtimi i kokcidiave të zorrëve
Kokcidioza diagnostikohet duke demonstruar oociste në feces. Ngjyrosja e shpejtë me acid është metoda e preferuar për kokcidiet që ngjyrosin me ngjyrë të kuqe të ndezur. Cryptosporidium, Cyclospora dhe Isospora dallohen nga madhësia dhe struktura e oocistit (Tabela). Cyclospora dhe Isospora nuk e marrin në mënyrë të njëtrajtshme njollën duke rezultuar në një përzierje të oocisteve të panjollosura, pjesërisht të ngjyrosura dhe plotësisht të njollosura. Ciklospora dhe Isospora mund të zbulohen gjithashtu nëpërmjet një autofluoreshence të lidhur me murin e kistit. Për shkak të madhësisë së saj relativisht të madhe, Isospora zbulohet lehtësisht në ekzemplarët e panjollosur. Sarcocystis është një infeksion i rrallë i njeriut ( shih më poshtë ) me oocistë të ngjashëm me Isospora , me përjashtim të faktit që sporocistet përgjithësisht lirohen nga oocistet ndërsa janë ende në lumenin e zorrëve.
| Parazitët koksidian të gjetur në fecesin e njeriut | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Trajtimi i rekomanduar për Cyclospora dhe Isospora është kombinimi i trimethoprim-sulfamethoxazole (Bactrim). Nuk ka një trajtim plotësisht të kënaqshëm për Cryptosporidium . Supozohet se vendndodhja 'ekstracitoplazmike' e Cryptosporidium e mbron atë nga barnat. Paromomycin është përdorur për trajtimin e kriptosporidiozës, megjithatë, efikasiteti i saj është i debatuar. Studimet e kontrolluara tregojnë se paromomycin shtyp në mënyrë modeste paraziteminë tek individët me imunitet të kompromentuar. Trajtimi i kriptosporidiozës së rëndë duhet të përfshijë kujdesin mbështetës (rihidrim dhe mbështetje ushqyese) dhe agjentë kundër lëvizshmërisë. Masat parandaluese do të jenë të ngjashme me sëmundjet e tjera të transmetuara nga rruga fekalo-orale (shih faktorët e rrezikut ose kontrolli Giardia ).
 |
 |
 |
 |
Cistet e indeve që formojnë kokcidia
Disa specie koksidiane shfaqin një cikël jetësor heteroksen në të cilin merogonia zhvillohet në indet e bujtësit të ndërmjetëm (preja) dhe gametogonia zhvillohet në epitelin intestinal të bujtësit përfundimtar (grabitqari). [Sipas marrëveshjes, riprodhimi seksual ndodh në strehuesit përfundimtarë.] Përsa i përket infeksioneve njerëzore, Toxoplasma është një kist i zakonshëm i indeve që formon parazit koksidian, ndërsa infeksionet me speciet Sarcocystis janë mjaft të rralla.
Cikli jetësor (shih figurën) të Sarcocystis brenda grabitqarit (dmth. mishngrënës) është i ngjashëm me ciklet e jetës së kokcideve të zorrëve, si Isospora , që përfshin një cikël seksual (gametogoni) brenda qelizave epiteliale të zorrëve. Një ndryshim në ciklin jetësor të Sarcocystis është mungesa e merogonisë në qelizat epiteliale të zorrëve. Me fjalë të tjera, merozoitët e fituar nga gëlltitja e një gjahu të infektuar do të prodhojnë gamete vetëm pas pushtimit të qelizave epiteliale të zorrëve. Shkrirja e gameteve çon në prodhimin e oocisteve. Për më tepër, sporocistet zakonisht lirohen nga oocistet brenda zorrës së bujtësit dhe për këtë arsye sporocistet infektive gjenden në feces.
Pritësit e ndërmjetëm (barngrënësit) e marrin infeksionin duke gëlltitur sporocistet e sporuluara. Sporozoitët çlirohen, pushtojnë qelizat epiteliale të zorrëve dhe i nënshtrohen merogonisë, siç është tipike për kokcidiet intestinale. Ndryshe nga kokcidia e zorrëve, merozoitët do të pushtojnë qelizat endoteliale dhe do të prodhojnë një infeksion sistemik. Shumë shpesh ka një tropizëm për inde të veçanta si truri ose muskujt. Merontet (ose skizontet) në këto inde shpesh janë të kapsuluara dhe quhen 'cista indore'. Këto kiste të indeve, ose sarkociste në rastin e muskujve, shpesh shfaqin një nivel më të ulët të riprodhimit gjatë merogonisë dhe janë disi të fjetura. Gëlltitja e kafshës së infektuar nga një mishngrënës do të çlirojë merozoitët të cilët do të pushtojnë qelizat epiteale të zorrëve dhe kështu do të kompletojnë ciklin jetësor.

Ky cikël jetësor grabitqar-pre nuk u realizua deri në vitet 1970. Më parë, infeksionet e zorrëve te grabitqari zakonisht përcaktoheshin si specie Isospora dhe infeksionet e indeve në gjahun zakonisht përcaktoheshin si specie Sarcocystis . Në shumë raste strehuesit përfundimtarë nuk janë identifikuar pozitivisht dhe taksonomia e shumë specieve Sarcocystis është e pasigurt.
Infeksionet e Sarcocystis tek njerëzit janë dokumentuar, por janë të rralla. Njerëzit janë nikoqiri përfundimtar për S. hominis (aka, S. bovihominis ) dhe S. suihominis siç përcaktohet nga burimi i infeksionit që është përkatësisht viçi ose derri. Gëlltitja e mishit të viçit ose derrit të papjekur nga kafshët e infektuara do të prodhojë një infeksion enterik i cili mund të shkaktojë simptoma akute të zorrëve (shqetësim abdominal, të përzier, diarre). Megjithatë, shumica e infeksioneve besohet se janë asimptomatike. Individët e infektuar mund të derdhin sporociste në feces për javë deri në muaj pas infeksionit. Sporokistet nga feçet e njeriut janë infektive për lopët, derrat dhe drerët.
Njerëzit gjithashtu mund të shërbejnë si pritës i ndërmjetëm për të paktën disa nga speciet Sarcocystis që gjenden në natyrë. Gëlltitja e sporocisteve nga njerëzit mund të rezultojë në fazën indore të infeksionit dhe formimin e sarkocisteve. Këto sarkocista janë përgjithësisht disa 100 μm në madhësi dhe shkaktojnë pak dëmtim të indeve. Simptomat klinike mund të përfshijnë ndjeshmëri të muskujve ose ënjtje episodike të dhimbshme inflamatore. Këto kiste muskulore te njerëzit janë raportuar vetëm në mënyrë sporadike (<100 raste të raportuara) dhe ndoshta përfaqësojnë infeksione aksidentale. Një studim vuri në dukje se sarkocistet te njerëzit prireshin t'i ngjanin specieve Sarcocystis që zakonisht gjenden te majmunët lokalë (Beaver et al, Am. J. Trop. Med. Hyg. 28:819, 1979). Shumica e rasteve janë raportuar nga Azia tropikale dhe subtropikale, duke përfshirë një shpërthim të sarkocistozës muskulare midis udhëtarëve që kthehen nga Malajzia ( MMWR 61:37 ).
Fayer, R (2004) Sarcocystis spp. në infeksionet njerëzore. Klin. Mikrobiol. Rev. 17: 894-902 .
 |
 |
 |
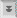 |
TOXOPLAZMOZA
Toxoplasma gondii është një parazit koksidian që infekton njerëzit, si dhe një shumëllojshmëri të gjerë të gjitarëve dhe shpendëve. Ajo shfaq një cikël jetësor të tipit grabitqar-pre (siç u diskutua më lart për Sarcocystis ) dhe macet janë i vetmi pritës përfundimtar. Toksoplazmoza gjendet në të gjithë botën (përveç klimës jashtëzakonisht të ftohtë ose të thatë) dhe ka tendencë të jetë më e përhapur në klimat tropikale. Studimet serologjike kanë treguar norma të prevalencës deri në 70% deri në moshën 25 vjeçare në disa popullata të Amerikës Qendrore. Në Shtetet e Bashkuara vlerësohet se 0,5-1% e popullsisë infektohet çdo vit dhe prevalenca varion nga 10-25% deri në moshën 25 vjeçare. Toksoplazmoza është më shpesh një sëmundje beninje. Përjashtimet e vërejtura janë në rastet e infeksionit kongjenital ose individëve me imunitet të kompromentuar .- Cikli i jetes
- Veçoritë klinike
- Diagnoza , Trajtimi dhe Parandalimi
Cikli i jetes
Toksoplazma ka një cikël jetësor kompleks të përbërë nga faza intestinale dhe indore. Edhe pse organizmi u zbulua për herë të parë në vitin 1908 si një parazit i indeve të gondi (një brejtës afrikan), cikli i plotë jetësor i tij nuk u përcaktua deri në vitin 1970. Faza intestinale e infeksionit ndodh vetëm tek macet dhe shfaq një cikël jetësor tipik koksidian të zorrëve që përbëhet nga të merogonisë dhe gamogonisë (shih ciklin jetësor Isospora ). Macet e marrin infeksionin duke ngrënë kafshë të infektuara me fazën indore të parazitit. Parazitët pushtojnë qelizat epiteliale të zorrëve dhe i nënshtrohen merogonisë. Merozoitët që rezultojnë pastaj mund t'i nënshtrohen raundeve shtesë të merogonisë ose t'i nënshtrohen gametogonisë. Ashtu si apikomplekset e tjera (shih ciklin e përgjithshëm të jetës së apikompleksit ) prodhohen makro dhe mikrogameta. Kështu, macja konsiderohet nikoqiri përfundimtar pasi ky është pritësi në të cilin ndodh cikli seksual. Mikrogametet e dyfishta lëshohen në lumenin e zorrëve dhe fekondojnë makrogametet brenda qelizave epiteliale të bujtësit. Sekretimi i murit të oocistit fillon menjëherë pas fekondimit. Ky cikël seksual arrin kulmin me prodhimin e oocisteve të cilat ekskretohen në feces. Këto oociste të papjekura i nënshtrohen sporogonisë në temperaturën e ambientit duke rezultuar në oociste të pjekura që përmbajnë dy sporociste, secila me katër sporozoite. Në përgjithësi, sporulimi zgjat 1-4 ditë dhe oocistet mbeten infektive për muaj të tërë në tokë të lagësht me hije. Është hipotezuar se makrogametet e pafertilizuara mund të jenë gjithashtu të afta të formojnë oociste të pjekura ( Ferguson, Tr. Parasitol. 18:351, 2002 ).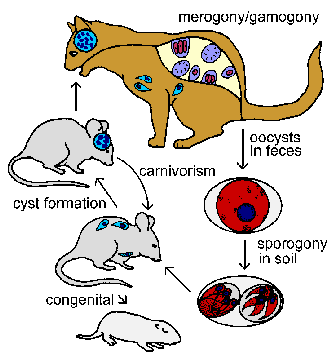 Pritësit e ndërmjetëm, të tillë si brejtësit dhe zogjtë, infektohen përmes gëlltitjes së oocisteve të sporuluara. Sporozoitët çlirohen, depërtojnë në epitelin e zorrëve dhe pushtojnë makrofagët dhe llojet e tjera të qelizave. Procesi i pushtimit është tipik për apikompleksën dhe paraziti shtrihet brenda një vakuole parazitofore. Brenda vakuolës, paraziti i nënshtrohet ndarjes binar (dmth., merogonisë) nga një proces unik i quajtur endodiogjeni. Endodiogjenia është një lloj i specializuar ndarjeje në të cilën dy qelizat bija formohen brenda qelizës amë. Këto forma trofike quhen takizoite ( tachy do të thotë i shpejtë) në lidhje me nivelin e tyre të lartë të replikimit. Qeliza pritëse do të çahet dhe do të lëshojë takizoitët të cilët do të pushtojnë qelizat e reja strehuese dhe do të përsërisin ciklin replikues. Makrofagët e infektuar do të shpërndajnë takizoitët në të gjithë bujtësin gjatë këtij infeksioni akut.
Ndërsa bujtësi zhvillon imunitetin, shpejtësia e replikimit do të ngadalësohet dhe qelizat e infektuara strehuese do të mbyllen (dmth., kistat e indeve). Këto forma që përsëriten ngadalë quhen bradyzoite ( brady do të thotë i ngadaltë) dhe përfaqësojnë një fazë të fjetur ose pushimi. Bradizoitët konsiderohen të jenë metabolikisht të qetë, por mbeten të zbatueshëm ( Dubey et al, Clin. Microbiol. Rev. 11:267, 1998 ). Ndryshime të tjera që ndodhin kur takizoitët shndërrohen në bradizoite përfshijnë sekretimin e kitinës dhe përbërësve të tjerë për të formuar një mur kisti dhe akumulimin e granulave të amilopektinës (duke reflektuar ruajtjen e glukozës). Kistet e indeve të Toxoplasma shfaqin një sërë madhësish, por shpesh marrin një madhësi prej 50-70 μm në diametër që përmban 1000-2000 bradizoite. Bradizoitët gjenden kryesisht në indet e trurit dhe të muskujve, ndërsa takizoitët priren të jenë në qelizat retikuloendoteliale.
Faza e bradizoitit përfaqëson një infeksion kronik dhe ndoshta vazhdon për jetën e bujtësit. Mekanizmi për këtë qëndrueshmëri është i panjohur. Disa kërkues besojnë se cistat e indeve shpërbëhen periodikisht dhe lëshojnë bradizoitët të cilët do të pushtojnë qelizat e reja pritëse dhe do të çojnë në formimin e më shumë cisteve të indeve.
Faza indore e infeksionit gjithashtu mund të transmetohet në mënyrë kongjenitale tek pasardhësit dhe tek bujtësit e tjerë të ndërmjetëm përmes mishngrënies. Gëlltitja e një kafshe të infektuar do të çlirojë bradizoitet nga cistat e indeve të cilat më pas infektojnë qelizat në bujtësin e ri. Ndoshta të gjithë gjitarët, përfshirë njerëzit, mund të infektohen me Toxoplasma . Ashtu si në rastin e marrjes së infeksionit përmes gëlltitjes së oocisteve, parazitët do të kalojnë një fazë akute të karakterizuar nga riprodhim i shpejtë i ndjekur nga një fazë kronike e karakterizuar nga kiste të indeve të fjetura. Gëlltitja e një hosti të ndërmjetëm të infektuar nga macja do të fillojë fazën intestinale të ciklit jetësor që përfshin merogoninë dhe gamogoninë në qelizat epitiale të zorrëve. Macet gjithashtu mund të mbështesin fazën e indeve të infeksionit.
Pritësit e ndërmjetëm, të tillë si brejtësit dhe zogjtë, infektohen përmes gëlltitjes së oocisteve të sporuluara. Sporozoitët çlirohen, depërtojnë në epitelin e zorrëve dhe pushtojnë makrofagët dhe llojet e tjera të qelizave. Procesi i pushtimit është tipik për apikompleksën dhe paraziti shtrihet brenda një vakuole parazitofore. Brenda vakuolës, paraziti i nënshtrohet ndarjes binar (dmth., merogonisë) nga një proces unik i quajtur endodiogjeni. Endodiogjenia është një lloj i specializuar ndarjeje në të cilën dy qelizat bija formohen brenda qelizës amë. Këto forma trofike quhen takizoite ( tachy do të thotë i shpejtë) në lidhje me nivelin e tyre të lartë të replikimit. Qeliza pritëse do të çahet dhe do të lëshojë takizoitët të cilët do të pushtojnë qelizat e reja strehuese dhe do të përsërisin ciklin replikues. Makrofagët e infektuar do të shpërndajnë takizoitët në të gjithë bujtësin gjatë këtij infeksioni akut.
Ndërsa bujtësi zhvillon imunitetin, shpejtësia e replikimit do të ngadalësohet dhe qelizat e infektuara strehuese do të mbyllen (dmth., kistat e indeve). Këto forma që përsëriten ngadalë quhen bradyzoite ( brady do të thotë i ngadaltë) dhe përfaqësojnë një fazë të fjetur ose pushimi. Bradizoitët konsiderohen të jenë metabolikisht të qetë, por mbeten të zbatueshëm ( Dubey et al, Clin. Microbiol. Rev. 11:267, 1998 ). Ndryshime të tjera që ndodhin kur takizoitët shndërrohen në bradizoite përfshijnë sekretimin e kitinës dhe përbërësve të tjerë për të formuar një mur kisti dhe akumulimin e granulave të amilopektinës (duke reflektuar ruajtjen e glukozës). Kistet e indeve të Toxoplasma shfaqin një sërë madhësish, por shpesh marrin një madhësi prej 50-70 μm në diametër që përmban 1000-2000 bradizoite. Bradizoitët gjenden kryesisht në indet e trurit dhe të muskujve, ndërsa takizoitët priren të jenë në qelizat retikuloendoteliale.
Faza e bradizoitit përfaqëson një infeksion kronik dhe ndoshta vazhdon për jetën e bujtësit. Mekanizmi për këtë qëndrueshmëri është i panjohur. Disa kërkues besojnë se cistat e indeve shpërbëhen periodikisht dhe lëshojnë bradizoitët të cilët do të pushtojnë qelizat e reja pritëse dhe do të çojnë në formimin e më shumë cisteve të indeve.
Faza indore e infeksionit gjithashtu mund të transmetohet në mënyrë kongjenitale tek pasardhësit dhe tek bujtësit e tjerë të ndërmjetëm përmes mishngrënies. Gëlltitja e një kafshe të infektuar do të çlirojë bradizoitet nga cistat e indeve të cilat më pas infektojnë qelizat në bujtësin e ri. Ndoshta të gjithë gjitarët, përfshirë njerëzit, mund të infektohen me Toxoplasma . Ashtu si në rastin e marrjes së infeksionit përmes gëlltitjes së oocisteve, parazitët do të kalojnë një fazë akute të karakterizuar nga riprodhim i shpejtë i ndjekur nga një fazë kronike e karakterizuar nga kiste të indeve të fjetura. Gëlltitja e një hosti të ndërmjetëm të infektuar nga macja do të fillojë fazën intestinale të ciklit jetësor që përfshin merogoninë dhe gamogoninë në qelizat epitiale të zorrëve. Macet gjithashtu mund të mbështesin fazën e indeve të infeksionit.
| Transmetimi Njerëzor |
|---|
|
| Zgjerimi i fundit i Toxoplasma ? |
|---|
Analiza molekulare e izolimeve të Toxoplasma (kryesisht nga Amerika e Veriut dhe Evropa) zbulon një diversitet të kufizuar gjenetik. Shumica (>94%) e izolimeve grumbullohen në tre linja klonale të dallueshme të përcaktuara si Tipi I, Tipi II dhe Tipi III. Këto tre linja klonale janë të lidhura ngushtë dhe përbëhen nga përzierje të ndryshme të vetëm dy aleleve në lokuset e testuara. Të tre llojet mund të kenë lindur nga rikombinimi gjenetik që ka ndodhur brenda 10,000 viteve të fundit (1). Kjo do të ishte në të njëjtën kohë me zgjerimin e bujqësisë njerëzore dhe përshtatjen e maces shtëpiake. Kështu, ndryshimet në sjelljen njerëzore mund të kenë çuar në një përzgjedhje dhe përhapje të shpejtë të Toxoplasma . Për më tepër, këto lloje klonale shfaqin të gjithë aftësinë për t'u transmetuar nëpërmjet një rruge direkte gojore midis nikoqirëve të ndërmjetëm, gjë që mund të mos ketë qenë një tipar biologjik i Toksoplazmës stërgjyshore ose specieve të tjera të lidhura ngushtë si Neospora ( shih kutinë më poshtë ). Ky përvetësim i infektivitetit të drejtpërdrejtë oral i kombinuar me zbutjen e kafshëve mund të nxisë një zgjerim të shpejtë, dhe kryesisht aseksual, të Toksoplazmës .Tre gjenotipet e Toxoplasma shfaqin gjithashtu ndryshime në virulencë (2). Për shembull, parazitët e tipit I janë shumë virulentë te minjtë. Në mënyrë të ngjashme, tipi I shoqërohet në mënyrë disproporcionale me toksoplazmozë të rëndë atipike okulare te individët imunokompetent dhe me toksoplazmozë të rëndë kongjenitale. Megjithatë, për fat të mirë, infeksionet e tipit II priren të dominojnë, veçanërisht në SHBA. Megjithatë, ka disa prova që sugjerojnë se Toxoplasma shfaq më shumë diversitet në Amerikën e Jugut. Përmirësimet në njohuritë tona rreth biologjisë së popullatës së Toksoplazmës mund të ndihmojnë në zgjidhjen e këtyre çështjeve dhe të çojnë në kontroll dhe trajtim më të mirë.
|
 |
 |
 |
 |
Veçoritë klinike
Toksoplazmoza tek të rriturit dhe fëmijët pas fazës neonatale është zakonisht beninje dhe asimptomatike. Përvetësimi i infeksionit nëpërmjet oocisteve ose kisteve të indeve rezulton në një infeksion akut në të cilin takizoitët shpërndahen në të gjithë trupin nëpërmjet limfatikëve dhe në mënyrë hematogjene. Kjo fazë akute do të vazhdojë për disa javë me zhvillimin e imunitetit. Prodhimi i antitrupave kërkon 1-2 javë dhe imuniteti qelizor ndodh 2-4 javë pas infektimit. Si imuniteti humoral ashtu edhe ai qelizor janë të rëndësishëm, por përgjigja qelizore duket kritike për shndërrimin nga infeksioni akut (d.m.th., takizoitët) në kronik (dmth. bradizoitët). (Shih ciklin jetësor për shpjegimin e taki- dhe bradizoiteve.) Në veçanti, një përgjigje e fortë Th1 e karakterizuar nga prodhimi i citokinave proinflamatore duke përfshirë interleukin-12, interferon-gama dhe faktorin-alfa të nekrozës së tumorit shoqërohet me infeksionin e Toksoplazmës . Kur shfaqen simptomat, ato janë përgjithësisht të lehta dhe zakonisht përshkruhen si mononukleozë me të dridhura, ethe, dhimbje koke, mialgji, lodhje dhe ënjtje të nyjeve limfatike. Këto simptoma janë vetëkufizuese dhe zgjidhen brenda javësh deri në muaj. Si simptomë e toksoplazmozës është vërejtur gjithashtu një limpadenopati kronike pa temperaturë që vazhdon ose përsëritet deri në një vit. Personat imunokompetent rrallë shfaqin simptoma të rënda dhe infeksioni akut pothuajse gjithmonë kalon në fazën kronike. Ky infeksion latent ndoshta vazhdon gjatë gjithë jetës së pacientit pa prodhuar ndonjë patologji progresive. Toksoplazmoza është vërejtur prej kohësh si një infeksion oportunist në lidhje me riaktivizimin e infeksioneve latente për shkak të imunosupresionit të lidhur me transplantet e organeve dhe disa trajtime të kancerit. Gjatë viteve 1980, encefaliti toksoplazmatik u shfaq si një ndërlikim i zakonshëm i lidhur me SIDA-n. Rreth 25-50% e pacientëve me SIDA me toksoplazmozë kronike do të zhvillojnë encefalit. Riaktivizimi i infeksionit zakonisht ndodh kur qelizat CD4 bien nën 100 qeliza për mikrolitër. Simptomat e hershme të encefalitit toksoplazmatik mund të përfshijnë dhimbje koke, ethe, letargji dhe ndryshim të statusit mendor me përparim në deficite neurologjike fokale dhe konvulsione. Sëmundja është pothuajse gjithmonë për shkak të një riaktivizimi të një infeksioni latent (shih Kutinë) dhe tenton të mbetet e kufizuar në SNQ. Me fjalë të tjera, cistat e indeve po çahen dhe bradizoitët e çliruar po shndërrohen në takizoitë. (Shih ciklin e jetës për shpjegimin e taki- dhe bradizoiteve.) Lezionet fokale shkaktohen nga shkatërrimi i qelizave bujtëse në afërsi. Forma të tjera të sëmundjes së riaktivizuar, veçanërisht retinokoroiditi, pneumoniti, miokarditi dhe mioziti, mund të ndodhin herë pas here në lidhje me imunosupresionin. Carlos S. Subauste, Toksoplazmoza dhe SIDA .| Rezultatet e infeksionit kongjenital | ||||||||
|---|---|---|---|---|---|---|---|---|
|
Toksoplazmoza kongjenitale
Toksoplazma gjithashtu mund të transmetohet në mënyrë kongjenitale (dmth. transplacental) nëse nëna e merr infeksionin gjatë shtatzënisë. Infeksionet kongjenitale (dmth. transplacentare) kanë më shumë gjasa të jenë simptomatike sesa infeksionet pas lindjes dhe mund të jenë veçanërisht të rënda (shih Kutinë e Rezultateve). Disa nga tiparet e spikatura janë:- transmetimi është i mundur vetëm gjatë fazës akute (dmth. infeksioni primar duhet të ndodhë gjatë shtatzënisë)
- mund të ndodhë vetëm një herë
- një e treta e nënave që shndërrohen në sero gjatë shtatzënisë do të kalojnë infeksionin tek fetusi
- incidenca midis 1 në 1000 dhe 1 në 10,000 lindje të gjalla
- ashpërsia ndryshon me moshën e fetusit (më e rëndë në fillim të shtatzënisë)
- transmetimi është më i shpeshtë më vonë në shtatzëni
- Infeksioni mund të rezultojë në: abort spontan, lindje të parakohshme ose afat të plotë me ose pa sëmundje progresive
- Manifestimet tipike të sëmundjes përfshijnë: retinokoroiditin, kalcifikimin intracerebral, hidrocefalinë, mikrocefalinë, shqetësimet psikomotore, vonesën mendore, verbërinë dhe defekte të tjera vizuale.
Toksoplazmoza okulare
Një retinokoroidit, inflamacion i retinës dhe koroidit (zona e trashë vaskulare në pjesën e pasme të syrit), është një tjetër manifestim klinik i infeksionit me Toxoplasma . Retinokoroiditi mund të rezultojë nga infeksione kongjenitale ose nga infeksione akute ose të riaktivizuara të fituara pas lindjes. Fillimisht manifestimet okulare shoqëroheshin më shpesh me infeksione kongjenitale ose me një manifestim të vonë për shkak të riaktivizimit të një infeksioni kongjenital. Megjithatë, toksoplazmoza okulare raportohet me frekuencë në rritje në lidhje me infeksionet akute. Është sugjeruar që gjenotipe të ndryshme shfaqin nivele të ndryshme të virulencës, veçanërisht në lidhje me shprehjen e sëmundjes okulare. Në rastin e infeksionit kongjenital, retinokoroiditi mund të zhvillohet javë deri në vite pas lindjes. Përafërsisht njëzet përqind e personave me infeksione kongjenitale do të shfaqin retinokoroidit në lindje dhe në adoleshencë 82% do të shfaqin simptoma. Lezionet janë të natyrës fokale dhe përgjithësisht vetëkufizohen. Ata besohet të jenë rezultat i këputjes së kistit në retinë në rastet e riaktivizuara ose takizoiteve në rastet akute. Qelizat e retinës ngjajnë shumë me ato të sistemit nervor qendror. Lezione granulomatoze mund të jenë gjithashtu të pranishme në koroid. Lezionet janë zakonisht dypalëshe në infeksionet kongjenitale dhe të njëanshme nëse fitohen pas lindjes. Studimet e kafshëve ofrojnë dëshmi se nekroza e retinës e lidhur me lezionin i atribuohet përhapjes së parazitëve, ndërsa përgjigjet e mbindjeshmërisë ndaj antigjeneve toksoplazmike janë përgjegjëse për inflamacionin shoqërues. Simptomat mund të përfshijnë shikim të paqartë ose defekte të tjera vizuale. Shikimi mund të përmirësohet me zgjidhjen e inflamacionit. Janë vërejtur përsëritje të sëmundjes, por shpeshtësia dhe faktorët që ndikojnë në rikthim nuk janë të qarta. Sëmundja është rrallë progresive te individët imunokompetent, por mund të dëmtojë retinën. Megjithatë, sëmundja mund të jetë mjaft e rëndë në pacientët me AIDS dhe të vazhdojë të përparojë.- GN Holland (2003) Toksoplazmoza okulare: një rivlerësim global: pjesa I: epidemiologjia dhe rrjedha e sëmundjes. Gazeta Amerikane e Oftalmologjisë 136, 973-988 .
- GN Holland (2004) Toksoplazmoza okulare: një rivlerësim global: pjesa II: manifestimet dhe menaxhimi i sëmundjes. Gazeta Amerikane e Oftalmologjisë 137, 1-17 .
 |
 |
 |
 |
Diagnoza, Trajtimi dhe Parandalimi
Ndryshe nga shumica e infeksioneve të tjera protozoare, diagnoza bëhet rrallë përmes zbulimit ose rikuperimit të organizmave, por mbështetet shumë në procedurat serologjike. Parazitët mund të zbulohen në ekzemplarët e biopsisë, qelizat e mbështjellësve ose lëngun cerebral kurrizor. Megjithatë, zbulimi i takizoiteve nga këto materiale mund të jetë i vështirë. Këto ekzemplarë mund të përdoren gjithashtu për të inokuluar minj ose qeliza të kulturës së indeve ose të analizohen me PCR. Megjithatë, rezultatet mund të jenë mashtruese, pasi shumë individë janë ekspozuar ndaj Toksoplazmës dhe kanë cista të indeve (bradizoite). Prandaj, analizat serologjike janë një komponent i rekomanduar i diagnozës. Diagnoza serologjike e Toksoplazmës është gjithashtu komplekse për shkak të prevalencës së individëve seropozitiv. Titrat e lartë të antitrupave në vetvete nuk janë dëshmi përfundimtare e një infeksioni akut. Infeksionet kongjenitale janë po aq të vështira për t'u diagnostikuar serologjikisht sepse IgG e nënës kalon placentën dhe vazhdon për disa muaj. Dëshmi për një infeksion akut janë titrat e lartë të IgM dhe/ose rritje të konsiderueshme në titrat total të antitrupave në lidhje me simptomat. Teknikat imazherike (CT, MRI) mund të jenë gjithashtu të dobishme në diagnostikimin e encefalitit toksoplazmatik. Indikacionet dhe kohëzgjatja e trajtimit :- Pacientët simptomatikë duhet të trajtohen derisa manifestimet të jenë ulur dhe të ketë dëshmi të imunitetit të fituar.
- Pacientët me retinokoroidit duhet të plotësohen me kortikosteroide për të shtypur inflamacionin.
- Gratë shtatzëna duhet të trajtohen me spiramicinë për të parandaluar infeksionin e fetusit.
- Të porsalindurit duhet të trajtohen për 12 muaj për të shmangur shfaqjet e mëvonshme të retinokoroiditit.
- Pacientët me imunitet të kompromentuar duhet të trajtohen. Terapia duhet të vazhdojë për 4-6 javë pas ndërprerjes së simptomave, e ndjekur nga profilaksia për aq kohë sa zgjat imunosupresioni.
- Kapitulli mbi Toxoplasma gondii nga JP Dubey
- Tenter et al (2000) Int. J. Parasitol. 30, 1217
- D. Hill, JP Dubey (2002) Toxoplasma gondii : transmetimi, diagnoza dhe parandalimi. Mikrobiologjia Klinike dhe Infeksioni 8:634-640 .
- DE Hill, S Chirukandotha dhe JP Dubey (2005) Biologjia dhe epidemiologjia e Toxoplasma gondii tek njerëzit dhe kafshët. Rishikimet e Kërkimeve për Shëndetin e Kafshëve 6:41-61 .
- JG Montoya dhe O Liesenfeld (2004) Toksoplazmoza. The Lancet 363:1965-1976 .
| Neospora caninum |
|---|
| Neospora caninum është e lidhur ngushtë me Toxoplasma gondii dhe shfaq një morfologji pothuajse identike. Ashtu si me Toxoplasma , Neospora infekton shumë kafshë shtëpiake dhe është një shkaktar kryesor i aborteve dhe lindjes së vdekur të bagëtive në mbarë botën. Pritësit përfundimtarë janë qentë që shfaqin sëmundje neuromuskulare. Njerëzit nuk janë një mikpritës. Qentë infektohen pas gëlltitjes së indeve të infektuara nga bujtësit e ndërmjetëm. Oocitet e pasporuluara derdhen në feces dhe sporulohen në mjedis. Pritësit e ndërmjetëm e marrin infeksionin duke gëlltitur oocistet e sporuluara. Megjithatë, ndryshe nga Toxoplasma , bujtësit e ndërmjetëm nuk mund ta marrin infeksionin duke gëlltitur forma të indeve nga bujtësit e tjerë të ndërmjetëm. Infeksioni mund të transmetohet në mënyrë kongjenitale dhe paraziti mbahet lehtësisht te bagëtia dhe qentë nëpërmjet transmetimit vertikal. Është identifikuar gjithashtu një cikël silvatik që përfshin drerët me bisht të bardhë dhe kojotë (Rosypal dhe Lindsay, Tr. Parasitol. 21, 349. 2005 ). |
 |
 |
 |
 |
Babezioza
| Shënim historik |
|---|
| Në 1893, Smith dhe Kilborne raportuan se rriqrat transmetojnë B. bigemina , shkaku i etheve të gjedhëve të Teksasit. Ky ishte demonstrimi i parë i një sëmundjeje të transmetuar nga artropodët dhe ka të ngjarë të frymëzoi zbulimin e mëvonshëm të sëmundjeve të tjera të transmetuara nga vektorët si ethet e verdha dhe malaria. |
 |
 |
 |
 |
Cikli i jetes
Babesia shfaq një cikël jetësor tipik apikompleks të karakterizuar nga merogonia, gametogonia dhe sporogonia (Figura). Infeksioni merret nga bujtësi vertebror kur sporozoitet (Sp) transferohen gjatë ushqyerjes së rriqrave. Sporozoitët pushtojnë eritrocitet duke përdorur një mekanizëm pushtimi që është i ngjashëm me Apikomplekset e tjera. (Shih diskutimin e detajuar mbi pushtimin e qelizave bujtëse nga paraziti i malaries .) Ndryshe nga Plasmodium , membrana vakuolare parazitofore (PVM) shpërbëhet pas pushtimit dhe paraziti është në kontakt të drejtpërdrejtë me citoplazmën e eritrocitit bujtës. Trofozoitët (Tr) ndahen me ndarje binar dhe prodhojnë merozoitë (Mz), të cilat infektojnë eritrocite shtesë dhe rifillojnë ciklin replikativ. Në disa specie, një tetrad, i referuar si një kryq maltez, vërehet herë pas here.
Disa nga trofozoitët do të zhvillohen në gametocite (Gm), ose gamonte, të cilat janë përgjegjëse për fillimin e infeksionit në vektorin e rriqrës. Gametocitet pësojnë ndryshime morfologjike brenda zorrëve të rriqrës dhe zhvillohen në trupa rreze (Rb; aka Strahlenkörper). Dy trupa rrezesh (dmth gametet) do të shkrihen për të formuar një zigotë (Zg) e cila më pas zhvillohet në një kinete (Ki). Kinete depërton në membranën peritrofike dhe epitelin e zorrëve për të fituar qasje në hemolimfë. Babesia e madhe , si B. divergens dhe B. canis , janë të afta të pushtojnë organe të ndryshme dhe t'i nënshtrohen përsëritjes së mëtejshme. Më i dukshëm është pushtimi i vezoreve dhe vezëve që çon në një transmetim transovarial tek pasardhësit e rriqrës.
Sporogonia fillon kur kinetet pushtojnë gjëndrat e pështymës. Paraziti zgjerohet dhe mbush një qelizë bujtëse të hipertrofizuar dhe zhvillohet në një sporoblast me shumë bërthama (Sb; aka sporont). Sporozoitët e pjekur, që zotërojnë organele apikale, do të mbijnë nga ky sporoblast i padiferencuar kur rriqrat ushqehen përsëri me një bujtës të ri. Pesë-dhjetë mijë sporozoite mund të prodhohen nga një sporoblast i vetëm. Më pas, sporozoitet do të injektohen në bujtësin me pështymë, duke përfunduar kështu ciklin jetësor.| Theileria dhe Limfoblastogjeneza |
|---|
| Speciet Theileria infektojnë dhe shkaktojnë sëmundje në bagëti, dhe veçanërisht në bagëti, në shumë pjesë të botës. Më e rënda është ethet e gjedhëve të Bregut Lindor, e shkaktuar nga T. parva . Ajo ka 90-100 për qind vdekshmëri në Afrikë. T. annulata shkakton një sëmundje më të lehtë të bagëtive përgjatë Mesdheut dhe në Lindjen e Mesme të njohur si theileriosis tropikale. Theileria janë të lidhura ngushtë me Babesia dhe shfaqin një cikël jetësor shumë të ngjashëm (Figura 16.1). Dallimi kryesor është një fazë para-eritrocitike e ekspozuar nga speciet Theileria . Edhe pse një stad i tillë paraeritrocitar dyshohet te B. microti . Sporozoitët pushtojnë limfocitet dhe nxisin proliferimin e limfociteve të bujtësit me një mekanizëm të panjohur. Paraziti zhvillohet në një skizont me shumë bërthama (d.m.th., meront) i cili i nënshtrohet ndarjes që përkon me replikimin e limfocitit proliferues, dhe kështu një skizont transferohet në secilin prej limfociteve bija. Merozoitët që rezultojnë pushtojnë eritrocitet dhe përfundimisht zhvillohen në gamonte të cilat janë infektive për rriqrat. Është procesi limfoproliferativ që çon në manifestimet e rënda të sëmundjes që lidhen me ileriozën. Ky transformim limfocitar është i kthyeshëm në atë që trajtimi çon në pastrimin e parazitëve dhe frenohet përhapja e mëvonshme e limfociteve. |
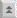 |
 |
 |
 |
Veçoritë klinike
Tek personat me shpretkë të paprekur, infeksioni përgjithësisht vetëkufizohet dhe karakterizohet nga një fillim gradual i sëmundjes, ethe, dhimbje koke, të dridhura, djersitje, mialgji, lodhje dhe dobësi. Një anemi hemolitike e lehtë deri në mesatare mund të shoqërojë gjithashtu këto simptoma. Shumë nga infeksionet do të zgjidhen vetë pa trajtim, por parazitët mund të vazhdojnë për muaj të tërë. Sëmundja ka tendencë të jetë më e ndezur dhe e rëndë te individët e splenektomizuar ose të imunosupresionuar dhe mund të jetë kërcënuese për jetën. Mund të shfaqen parazitemi > 25% dhe anemi të rënda.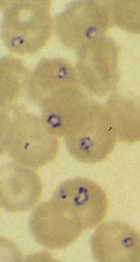 Diagnoza konfirmohet duke zbuluar parazitin në analizat e gjakut të ngjyrosura me Giemsa. Ekziston mundësia që Babesia të ngatërrohet me parazitin e malaries për shkak të disa ngjashmërive morfologjike me parazitët e fazës unazore Plasmodium (shih Figurën e B. microti ). Serologjia, mungesa e përgjigjes ndaj anti-malarialeve dhe mungesa e historisë së udhëtimit janë faktorë të tjerë që duhen marrë parasysh në vendosjen e diagnozës.
Nuk ka ilaçe qartësisht efektive kundër babeziozës. Trajtimi i rekomanduar është klindamicina + kininë. Pentamidina është treguar gjithashtu se shtyp, por jo eliminon paraziteminë. Klorokina, megjithëse nuk duket se ndikon në paraziteminë, ofron një lehtësim simptomatik, i cili mund të jetë për shkak të vetive të tij anti-inflamatore. Atovakuoni + azitromicina është treguar të jetë po aq efektive sa klindamicina + kinina, por me më pak efekte negative (Krause et al, 2000, N. Engl. J. Med 343:1454). Transfuzioni i shkëmbimit është përdorur si një përpjekje për të shpëtuar jetën në pacientët e sëmurë rëndë.
Rishikim mbi babeziozën:
Diagnoza konfirmohet duke zbuluar parazitin në analizat e gjakut të ngjyrosura me Giemsa. Ekziston mundësia që Babesia të ngatërrohet me parazitin e malaries për shkak të disa ngjashmërive morfologjike me parazitët e fazës unazore Plasmodium (shih Figurën e B. microti ). Serologjia, mungesa e përgjigjes ndaj anti-malarialeve dhe mungesa e historisë së udhëtimit janë faktorë të tjerë që duhen marrë parasysh në vendosjen e diagnozës.
Nuk ka ilaçe qartësisht efektive kundër babeziozës. Trajtimi i rekomanduar është klindamicina + kininë. Pentamidina është treguar gjithashtu se shtyp, por jo eliminon paraziteminë. Klorokina, megjithëse nuk duket se ndikon në paraziteminë, ofron një lehtësim simptomatik, i cili mund të jetë për shkak të vetive të tij anti-inflamatore. Atovakuoni + azitromicina është treguar të jetë po aq efektive sa klindamicina + kinina, por me më pak efekte negative (Krause et al, 2000, N. Engl. J. Med 343:1454). Transfuzioni i shkëmbimit është përdorur si një përpjekje për të shpëtuar jetën në pacientët e sëmurë rëndë.
Rishikim mbi babeziozën:
- Vannier E dhe Krause PJ (2012) Babezioza e Njeriut. NEJM 366:23972407 .